Grundbegriffe der Elektrizität
Wie in jedem Berufszweig, so hat sich auch in der Elektrotechnik / Elektronik eine eigene Sprache (Fachvokabular) entwickelt. Sie dient dazu, die speziellen Gegebenheiten, die physikalischen Gesetzmäßigkeiten, mit denen die Ströme und Spannungen gesteuert und beeinflusst werden, sowie die Bauteile und deren Eigenschaften unmissverständlich zu beschreiben. Hinzu kommt, dass Verständnis und Grundlagenwissen aus weiteren wissenschaftlichen Fachbereichen notwendig sind (Chemie, Werkstoffkunde, Steuer- und Regelungstechnik, Mathematik, Daten- und Kommunikationstechnik usw.). Somit ist es ratsam, sich am Anfang auf die Grundlagen zu konzentrieren, um bei dieser großen Bandbreite, die der Begriff Elektrotechnik / Elektronik trotz Spezialisierung umfasst, nicht den Überblick zu verlieren. Und wer sich für den Beruf des Elektrikers in der Industrie entschiedet, für den kommen noch weitere Technikbereiche hinzu (Mechanik, Pneumatik, Fluidtechnik, Hydraulik usw.).
Also, tauchen wir Schritt für Schritt in den Mikrokosmos der Elektrizität ein.
Atome und Elektronen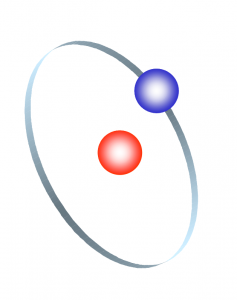
Das Wort Atom hat seinen Ursprung in der griechischen Sprache und bedeutet soviel wie unteilbar bzw. kleinster Materieteil eines chemischen Grundstoffes. Bis in die heutige Zeit gelten die Atommodelle von Rutherford und Bohr als Grundlage für die Erklärung der physikalisch-chemischen Zusammenhänge und dem Aufbau der Materie. Jedoch sind durch neue Erkenntnisse in der Physik auch zahlreiche neue Atommodelle entstanden (Stichworte zum Nachschlagen: Quantenmechanik, Quark-Physik, Stringtheorie). Der Einfachheit wegen wollen wir beim Modell nach Rutherford und Bohr „der auf bestimmten, erlaubten Planetenbahnen um den Atomkern laufenden Elektronen“ bleiben. Denn es bietet eine anschauliche Möglichkeit, die Wirkungsweise und Vorgänge in der Elektrotechnik und Elektronik zu beschreiben und zu verstehen.
Nach diesem Modell besteht ein Atom aus einem Atomkern und seinen Elektronenschalen.
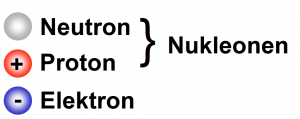
Der Atomkern besteht aus Neutronen (elektrisch neutral) und den positiv geladenen Protonen.
Protonen und Neutronen, zusammen
auch Nukleonen genannt, bilden den Atomkern.
Im Atomkern ist fast die gesamte Masse eines Atoms konzentriert.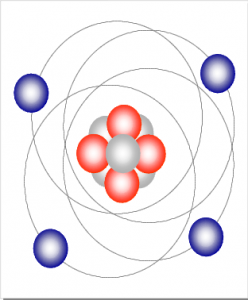 In den Elektronenschalen bzw. Elektronenhüllen umkreisen die negativ geladenen Elektronen in kreisförmigen oder elliptischen Bahnen den Atomkern. Maximal sieben solcher Elektronenschalen sind bekannt. In jeder dieser Elektronenschalen kann sich nur eine bestimmte Höchstzahl an Elektronen befinden. Zur Unterscheidung der Schalen werden diese jeweils von innen nach außen über die Großbuchstaben K bis Q oder durch die Ziffern 1 bis 7 gekennzeichnet.
In den Elektronenschalen bzw. Elektronenhüllen umkreisen die negativ geladenen Elektronen in kreisförmigen oder elliptischen Bahnen den Atomkern. Maximal sieben solcher Elektronenschalen sind bekannt. In jeder dieser Elektronenschalen kann sich nur eine bestimmte Höchstzahl an Elektronen befinden. Zur Unterscheidung der Schalen werden diese jeweils von innen nach außen über die Großbuchstaben K bis Q oder durch die Ziffern 1 bis 7 gekennzeichnet.
Elektronen bilden die Elektronenhülle.
 Die Elektronen in der äußersten Schale werden als Valenzelektronen bezeichnet. Diese Valenzelektronen sind von besonderer Bedeutung für ein Atom. Sie bestimmen die Fähigkeiten eines Atoms, chemische Verbindungen mit anderen Atomen einzugehen. Diese chemischen Verbindungen zwischen Atomen werden als Moleküle bezeichnet.
Die Elektronen in der äußersten Schale werden als Valenzelektronen bezeichnet. Diese Valenzelektronen sind von besonderer Bedeutung für ein Atom. Sie bestimmen die Fähigkeiten eines Atoms, chemische Verbindungen mit anderen Atomen einzugehen. Diese chemischen Verbindungen zwischen Atomen werden als Moleküle bezeichnet.
Durch die Fliehkraft müssten eigentlich die mit hoher Geschwindigkeit um den Atomkern kreisenden Elektronen ihre Kreisbahn verlassen und vom Atomkern wegfliegen. Da das aber nicht der Fall ist, müssen zwischen dem Atomkern und den Elektronen bestimmte Kräfte (Anziehungskräfte) gegen die Fliehkraft wirken. Diese Anziehungskräfte beruhen auf elektrischen Ladungen in den Protonen und den Elektronen.
Protonen sind positive Ladungsträger (e+).
Neutronen sind elektrisch neutral.
Elektronen sind negative Ladungsträger (e–).
Somit wirken zwischen dem Atomkern und den Elektronen elektrische Kräfte. Ursache für diese elektrischen Kräfte ist die elektrische Ladung, die auch als Elementarladung bezeichnet wird.
Ursache für die elektrischen Kräfte
sind die elektrischen Ladungen.
In Versuchen hat man festgestellt, dass sich gleichnamige Ladungen abstoßen und ungleichnamige Ladungen anziehen.
Gleichnamige Ladungen stoßen sich ab.
Ungleichnamige Ladungen ziehen sich an.
 Ist die Anzahl der Elektronen und der Protonen gleich, so heben sich die elektrischen Ladungen gegenseitig auf und das Atom ist nach Außen hin elektrisch neutral. Man spricht dann von einem neutralen Atom.
Ist die Anzahl der Elektronen und der Protonen gleich, so heben sich die elektrischen Ladungen gegenseitig auf und das Atom ist nach Außen hin elektrisch neutral. Man spricht dann von einem neutralen Atom.
Bei gleicher Anzahl positiver (Protonen) und negativer (Elektronen) Ladungsträger,
ist das Atom nach außen hin elektrisch neutral, da sich die Wirkungen gegenseitig aufheben.
Ist das Verhältnis zwischen Elektronen und Protonen ungleich, so spricht man von einem Ion.
Positiv oder negativ geladene Atome werden als Ionen bezeichnet.
Hat ein Atom weniger Elektronen als Protonen (positives Ion), so wirkt es nach Außen positiv geladen und zieht somit negative Ladungen an. Umgekehrt zieht ein negatives Ion (mehr Elektronen) positive Ladungen an. Dies bedeutet, negative Ladung entsteht durch einen Elektronenüberschuss und positive Ladung entsteht durch Elektronenmangel.
Elektronenüberschuss bewirkt eine negative Ladung.
Elektronenmangel bewirkt eine positive Ladung.
Die Unterscheidung der Atome erfolgt aufgrund mehrerer Merkmale. Anzahl an Protonen, Neutronen und Elektronen, Anzahl der Elektronenschalen, ihrer Massen, dem Temperaturverhalten, ihrer Eigenschaften usw. Zur besseren Übersicht wurde darum das „Periodensystem der Elemente“ entwickelt, in dem die Atome (Elemente) über Ordnungszahlen geordnet und gekennzeichnet sind (Stichworte zum Nachschlagen: Periodensystem).
Aufgrund der Eigenschaft, dass die Atome das Bestreben haben, ihre äußerste Elektronenschale mit der maximal möglichen Anzahl an Elektronen zu besetzen, versuchen sie dies über die bereits genannte chemische Verbindung mit anderen Atomen (Molekülbildung) zu erreichen.
Hierbei sind drei unterschiedliche Bindungsarten möglich:
- Ionenbindung
- Atombindung
- Metallbindung
Ionenbindung
Ionenbindungen sind nur zwischen Atomen verschiedener Elemente möglich.
Atome mit nur wenigen Valenzelektronen geben diese leicht ab und werden so zu einem positiven Ion. Im Gegenzug nehmen Atome mit mehreren Valenzelektronen leichter neue Elektronen auf, um die maximal mögliche Anzahl an Elektronen in ihrer äußersten Hülle zu erreichen. Sie werden dann zu einem negativen Ion. Durch die Kraftwirkung der elektrischen Ladungen (siehe oben) gehen die ungleichnamigen Ionen eine feste Bindung ein und ein neuer Stoff entsteht.
Dieser Mechanismus der Ionenbindung ist z.B. für den Transport elektrischer Ladungen in Flüssigkeiten und Gasen von Bedeutung.
Atombindung
Im Vergleich zur Ionenbindung können bei der Atombindung auch Atome gleicher Elemente eine Bindung eingehen. Am Beispiel mit Sauerstoffatomen soll dies verdeutlicht werden. Sauerstoffatome haben auf ihrer äußersten Schale jeweils 6 Elektronen. Die Atombindung kommt dadurch zustande, indem ein Atom jeweils zwei Valenzelektronen dem anderen Atom zur Verfügung stellt. Somit entstehen aus je einem Elektron der beiden Atome zwei Elektronenpaare, die zu beiden Atomen gehören. Die Außenschalen der beiden Sauerstoffatome sind damit zeitweise mit je 8 Elektronen voll besetzt.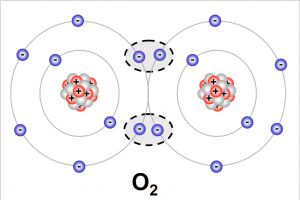
Der Mechanismus der Atombindung ist für die Herstellung von Halbleitermaterial von großer Bedeutung. Halbleitermaterial ist für den Leitungsmechanismus in vielen elektronischen Bauteilen (Dioden, Transistoren, Thyristoren usw.) notwendig. Durch die feste Verankerung von Valenzelektronen mit den jeweiligen Nachbaratomen ist zwar die elektrische Leitfähigkeit dieser Halbleiter nur sehr gering, diese kann aber durch den gezielten Einbau von bestimmten Fremdatomen in weiten Grenzen verändert und beeinflusst werden.
Halbleiter sind Stoffe, bei denen erst durch äußere Einflüsse
Valenzelektronen frei werden und dadurch die Leitfähigkeit eintritt
Die verwendeten Halbleiterstoffe in der Elektronik sind Silizium, Selen, Germanium und Kupferoxidul.
Metallbindung
Durch die Art der Bindung, die Metallatome miteinander eingehen, ergibt sich eine gute Leitfähigkeit für Elektrizität und Wärme. Beim überwiegenden Teil der Elemente handelt es sich um Metalle. Typisch für die Metallatome ist, dass sie relativ leicht alle Valenzelektronen abgeben. Metalle haben somit viele freie Ladungsträger und sind dadurch die in der Elektrotechnik / Elektronik am meisten verwendeten Werkstoffe.
In Bezug auf die Elektrotechnik / Elektronik unterscheidet man deshalb in Abhängigkeit von der Leitfähigkeit der Stoffe zwischen elektrischen Nichtleitern, Halbleitern und Leitern.
Nichtleiter
Unter den Nichtleitern gibt es feste Stoffe, Flüssigkeiten und Gase.
Je nach Art der Nichtleiter werden sie als Isolierstoffe zur Isolierung stromführender Leiter verwendet.
Bei den festen Stoffen sind dies bevorzugt:
Kunststoffe, Gummi, Glas, Porzellan, Glimmer und auch Lacke.
Aber auch Öle und Gase oder Vakuum werden für Spezialfälle verwendet (Transformatoren, Leistungsschalter, Leuchtmittel).